급성담낭염에서 내시경 경유두 담낭배액술의 효과
서울특별시 보라매병원 소화기내과 장동기
급성담낭염에서 내시경 경유두 담낭배액술의 효과
Endoscopic Gallbladder Stenting to Prevent Recurrent Cholecystitis in Deferred Cholecystectomy: A Randomized Trial
(Gastroenterology 2024;166:1145–1155)
현재 가이드라인에서는 급성담낭염 환자에 대한 치료로 조기 복강경담낭절제술을 권고하고 있습니다. 그러나 환자의 상태가 불안정하거나, 기저질환의 문제, 그리고 최근의 COVID-19 유행으로 인해 조기수술이 어려운 경우가 많아졌습니다. 이러한 경우 항생제 투약하면서 보존적치료를 하거나, 항생제로 호전이 안되는 경우 경피적 담낭배액술을 고려하는 것이 일반적입니다. 그러나 경피적 담낭배액술은 시술관련 부작용의 발생비율이 높고, 담낭절제술을 시행할 때까지 외부배액관을 밖으로 달고 다녀야 하므로 불편합니다. 따라서 이러한 불편함을 줄이기 위해 내시경적 접근을 통한 담낭배액술이 최근 많이 시행되고 있는데 초음파내시경 유도하 담낭배액술 또는 내시경 경유두 담낭배액술을 고려할 수 있습니다. 그러나 초음파내시경 유도하 담낭배액술은 수술 시에 누공을 봉합해야 하는 문제가 있어서 보통 수술을 전혀 고려하지 못하는 경우에 시행됩니다. 내시경 경유두 담낭배액술은 내시경역행담췌관조영술 (ERCP, endoscopic retrograde cholangiopancreatography)을 시행하면서 같이 진행할 수 있으므로 총담관담석이 동반된 급성담낭염 환자에서 고려할 수 있으나 아직까지 이 시술의 효과에 대한 전향적인 연구는 없었습니다.
1. 본 연구는 2020년부터 2023년까지 급성결석성담낭염으로 진단받고, 총담관결석이 동반되었을 가능성이 높은 환자를 대상으로 태국의 한 병원에서 진행되었습니다. 여러 이유로 수술이 3개월 이상 연기된 환자들만 등록되었고, ERCP 과정에서 내시경 경유두 담낭배액술을 시행하는 군과 시행하지 않는 군으로 무작위 배정되었습니다.
2. 내시경 경유두 담낭배액술은 ERCP 과정에서 총담관담석을 모두 제거한 후 바로 이어서 진행되었습니다. 담낭관(cystic duct)을 먼저 cannulation하고, 담낭 내 유도철선을 거치한 후 담낭내부에 스텐트를 삽입하는 과정이 진행되었고, 담낭관 cannulation이 어려운 경우에는 SpyGlass 담도경을 이용하여 시행하였습니다.
3. 총 120명의 급성결석성담낭염 환자들이 내시경 경유두 담낭배액술 군(A)으로 60명, 시행하지 않는 군(B)으로 60명 배정이 되어 추적관찰하였습니다. A군의 시술 성공률은 90%였고, 시술이 성공한 경우 임상적 호전이 100%에서 확인되었습니다. 일차유효성변수인 3개월 내 담낭염 재발률은 A군에서 0%, B군에서 18.3% (11/60)로 확인되어, 매우 유의한 차이를 보였습니다.
4. 내시경 경유두 담낭배액술 시술과 관련된 부작용은 A군에서 21.7% 발생하였는데, 일시적인 저산소증이 8.3%, 경증 췌장염이 10.2%, 출혈이 3.3%였고, 대부분 보존적 치료로 호전되었습니다. 전체적인 시술 부작용은 B군에서 다소 적게 나타났지만 통계적으로 유의하지는 않았고, 시술시간은 A군에서 평균 39.2 분으로 B군의 35.5분에 비해 다소 길었지만, 유의한 차이는 아니었습니다.
5. 3-6개월 사이에 A군에서 28명(46.7%), B군에서 30명(50%)이 담낭절제술을 시행받았습니다. 6개개월시점에 분석해보았을 때, 3개월 이후 재발률은 A군과 B군 사이에 유의한 차이를 보이지 않았습니다.
논문 바로가기 ▶
담도암의 진단 및 치료
성균관의대 삼성서울병원 소화기내과 최영훈
고혈압, 당뇨 외 특이병력 없던 70세 남자가 검진 복부초음파에서 발견된 간내 종괴로 내원하였습니다. 혈액검사 및 영상검사 소견은 다음과 같았습니다.
WBC 7,850/mm3, Hb 7.3g/dL, Platelet 161,000/mm3
AST 61 U/L, ALT 49 U/L, ALP 225 U/L, GGT 94 U/L, Total bilirubin 0.5mg/dL
CA 19-9 432 IU/mL
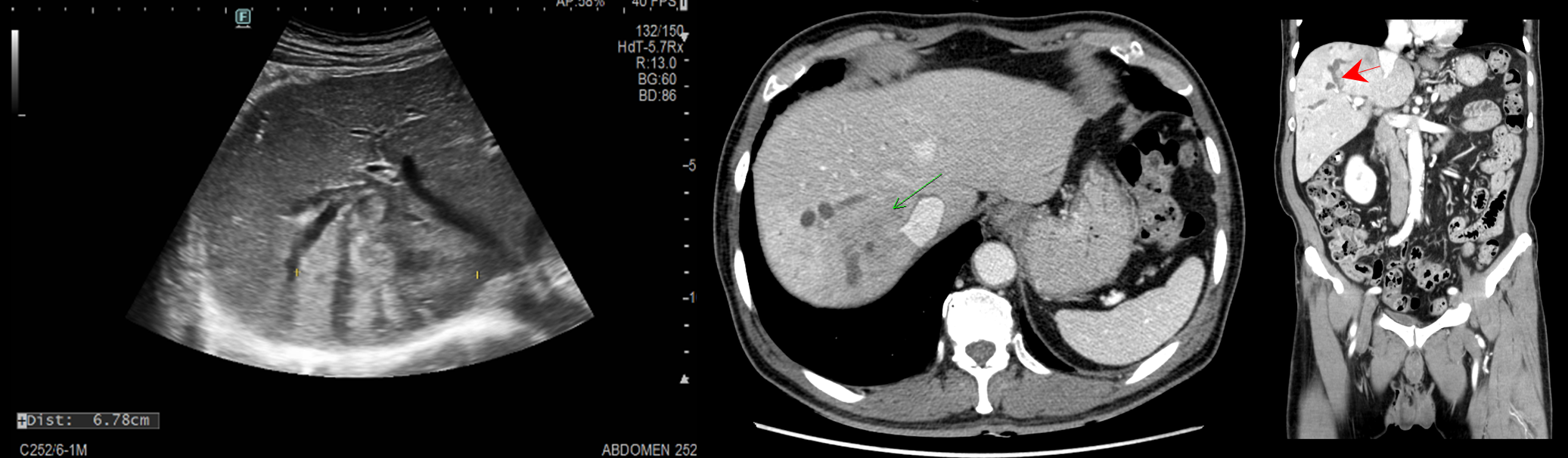 [그림1] 복부초음파[그림 2] 복부 CT
[그림1] 복부초음파[그림 2] 복부 CT
복부초음파에서 6.8cm 크기의 heterogenous echoic mass 가 liver segment 7 (S7)에서 관찰되었으며 이로 인한 간내담관의 확장 소견으로 r/o mass-forming cholangiocarcinoma가 의심되었습니다. 복부 CT에서도 S7에 7cm 가량의 mass 가 관찰되었고, 간내담관 중 특히 Right posterior intrahepatic duct 의 확장이 두드러졌으며 늘어난 담관 안에 intraductal growing tumor 의심되는 병변이 보였습니다 (붉은화살표).
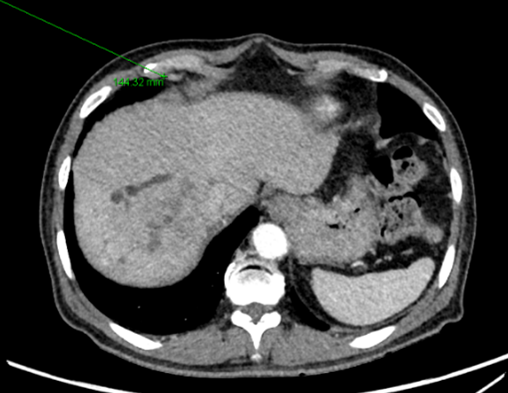
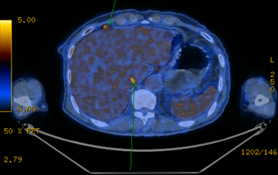 [그림 3] 흉부 CT[그림 4] PET-CT
[그림 3] 흉부 CT[그림 4] PET-CT
흉부 CT 에서는 middle diaphragmatic area 에 림프절 비대를 보이며 해당 병변은 PET-CT 에서도 hypermetabolic lesion 으로 전이성 림프절 소견을 보였습니다.
- 질문
- 이 환자에서 향후 고려해야 할 치료와 추가로 시행해야 할 검사는?
- 해설
- 환자는 영상검사에서 distant lymph node 에 전이 소견을 동반한 간내담도암이 가장 의심되는 환자로 수술적 절제는 어려운 상태입니다. 이에 향후 항암치료를 고려해야 하겠으며 그 전에 조직검사를 통한 조직학적 확진이 필요합니다.
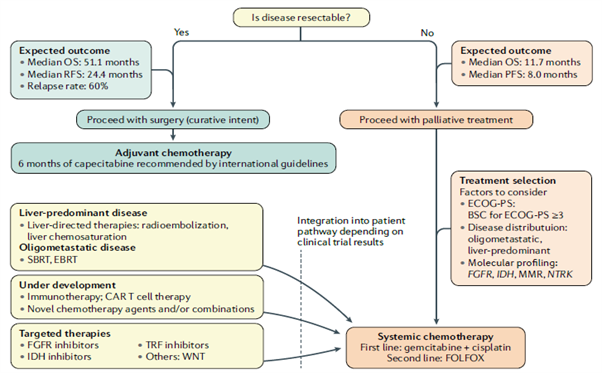 [그림 5] Treatment algorithm for cholangiocarcinoma (Nature Rev Gastro Hepatol 2020;17:557–588)
[그림 5] Treatment algorithm for cholangiocarcinoma (Nature Rev Gastro Hepatol 2020;17:557–588)
환자는 간내 종괴에 대한 조직검사를 위해 복부초음파를 통한 간조직검사를 시도하였으나 조직검사를 위한 needle 이 지나가는 경로에 늘어난 담관이 위치하여 조직검사 후 담즙 유출 등을 우려하여 복부초음파 통한 조직검사를 시행하지 못하였습니다.
- 질문
- 이후 적절한 검사 방법은?
- 해설
- 담즙 배액을 통한 intrahepatic decompression 을 위해 내시경역행담관조영술을 통한 담관배액술을 시도해볼 수 있겠으며, CT 에서 intraductal growing tumor 가 의심되었던 환자로 해당 간내담관으로 접근이 가능하다면 brush cytology 를 시도해볼 수 있겠습니다. Brush cytology 검사를 위한 brush의 경우 guidewire 를 타고 들어가 간내담관으로 접근이 비교적 용이하지만 biopsy forcep 을 이용한 검사는 간내담관의 병변으로 접근이 어려운 경우가 있겠으며 최근에는 Spyglass 등의 single operator cholangioscopy 를 이용한 접근이 가능하겠으나 담관 직경이 작은 경우 이를 통한 접근에도 다소 제한이 있을 수 있습니다.
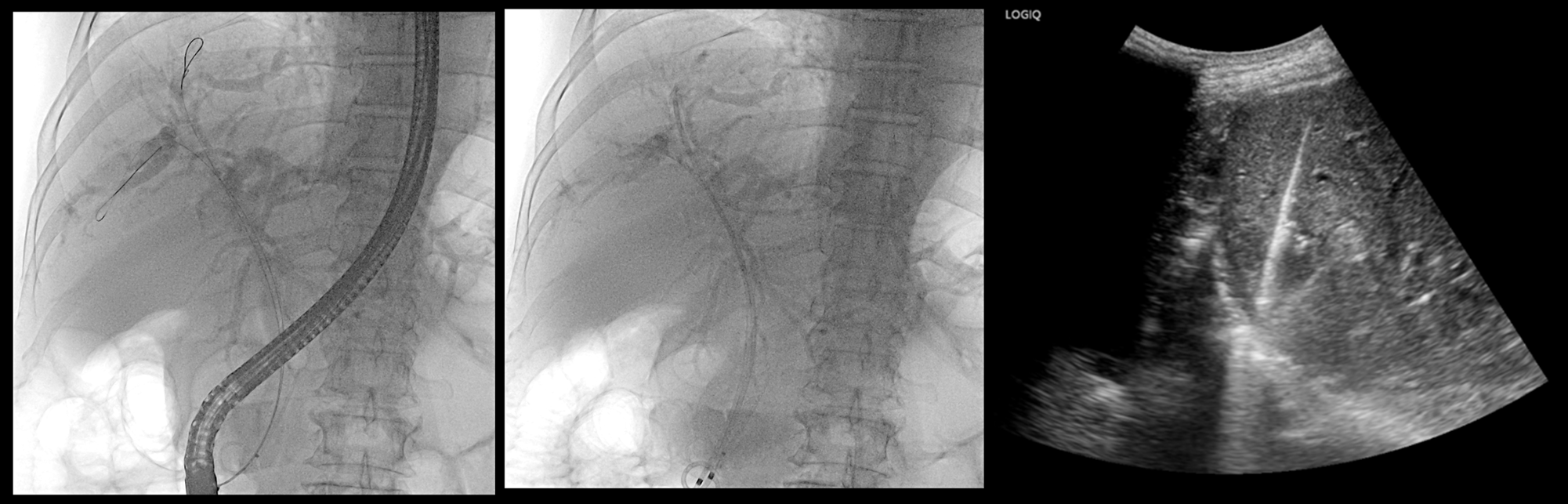 [그림 6] ERCP[그림 7] 복부초음파
[그림 6] ERCP[그림 7] 복부초음파
환자는 ERCP 시행하여 intraductal growing tumor 부위에서 brush cytology 시행 및 플라스틱 스텐트를 삽입하여 배액술 시행하였으며, 이후에 복부초음파를 통해 간내 종괴에서 조직검사 시행하였습니다. Brush cytology 및 간내 조직검사 모두에서 Adenocarcinoma 로 진단되어 간내담관암으로 조직학적으로 확진되었습니다.
- 질문
- 현재 환자에게 권고되는 항암화학요법은?
- 해설
- 절제가 불가능한 담도계암에서 현재 권고되는 항암화학요법은 gemcitabine + cisplatin 요법에 immune checkpoint inhibitor 를 병합한 요법인 (1) Durvalumab + gemcitabine + cisplatin 또는 (2) Pembrolizumab + gemcitabine + cisplatin 요법이며 (3) Gemcitabine + cisplatin 요법도 여전히 1차로 사용해볼 수 있는 항암화학요법입니다.
 [그림 8] Primary treatment for unresectable and metastatic biliary tract cancers (NCCN guideline version 4.2024)
[그림 8] Primary treatment for unresectable and metastatic biliary tract cancers (NCCN guideline version 4.2024)
- 질문
- 담도암 환자 등에서 쓰이는 immune checkpoint inhibitor 에 대한 반응을 예측할 수 있는 방법이 있나요?
- 해설
- 현재까지 FDA 승인된 immune checkpoint inhibitor 에 대한 biomarker 는 (1) tumor cell 의 PD-L1 발현, (2) High microsatellite instability (MSI-H), (3) High tumor mutation burden (TMB) 이 있으나 이 세가지의 biomarker 도 immune checkpoint inhibitor 에 대한 반응 예측이 30-50% 미만에서만 가능하다고 알려져 있어 새로운 biomarker 에 대한 연구가 필요합니다.
Key Messages
1. 담도암의 치료 방침 결정을 위해서는 우선 절제가능 여부를 판단해야 하며 이를 위해복부 및 흉부 CT를 포함한 검사가 필요합니다.
2. 절제가 불가능한 담도암의 치료를 위해서는 조직학적 확진을 위한 조직검사가 필요하며 항암화학요법을 치료로 고려할 수 있는데 현재 1차로 권고되는 항암화학요법은 (1) Durvalumab + gemcitabine + cisplatin, (2) Pembrolizumab + gemcitabine + cisplatin, (3) Gemcitabine + cisplatin 요법이 있습니다.
3. Immune checkpoint inhibitor 에 대한 반응을 예측하는 biomarker 로는 PD-L1 발현, MSI-H, TMB 가 알려져 있으나 그 예측력이 좋은 편은 아니어서 새로운 biomarker에 대한 연구가 필요합니다.
References
1. Banales JM, Marin JJG, Lamarca A, Rodrigues PM, Khan SA, Roberts LR, et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol. 2020;17(9):557-88.
2. Valle J, Wasan H, Palmer DH, Cunningham D, Anthoney A, Maraveyas A, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med. 2010;362(14):1273-81.
3. Oh DY, Ruth He A, Qin S, Chen LT, Okusaka T, Vogel A, et al. Durvalumab plus Gemcitabine and Cisplatin in Advanced Biliary Tract Cancer. NEJM Evid. 2022;1(8):EVIDoa2200015.
4. Kelley RK, Ueno M, Yoo C, Finn RS, Furuse J, Ren Z, et al. Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023;401(10391):1853-65.
5. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®), Biliary Tract Cancers. Version 4.2024
6. Holder AM, Dedeilia A, Sierra-Davidson K, Cohen S, Liu D, Parikh A, et al. Defining clinically useful biomarkers of immune checkpoint inhibitors in solid tumours. Nat Rev Cancer. 2024;24(7):498-512.
응혈괴 부착을 동반한 소화성 궤양 치료: 내시경 치료 대 약물치료
가톨릭대학교 김일수
응혈괴 부착을 동반한 소화성 궤양에서의 내시경적 치료와 약물치료에 대한 체계적 문헌 고찰과 메타분석
Systematic review and meta-analysis of endoscopic versus medical management of peptic ulcers with adherent clots (J Gastroenterol Hepatol. 2024 Oct;39(10):2031-2042.)
현재 우리나라를 비롯한 미국과 유럽의 가이드라인에서는 응혈괴 부착(Adherent clot)이 동반된 소화성 궤양인 Forrest IIb에 있어서, 내시경적 치료와 약물적 치료 중 어느 것도 추천하지 않습니다. 응혈괴 부착된 궤양에서 재출혈 확률은 20-30%가량으로 알려져 있습니다. 이에 대한 기존의 두 개의 메타분석에서 재출혈에 대한 내시경 치료와 약물치료의 결과가 상의하였습니다. 이에 본 연구는 기존 연구에서 사용된 무작위대조시험(RCT) 자료와 새로운 무작위대조시험 자료를 이용해, 새로이 분석하였습니다.
1. 본 연구는 2022년 9월까지의 발표된 7개의 무작위대조시험 자료를 이용하여 총 268명의 환자를 대상으로 메타분석을 하였습니다.
2. 내시경적 치료 또는 단독 약물치료를 받은 대상 중 Forrest IIb인 대상자만 선정하였습니다. 그리고 재출혈, 사망, 외과적 수술 필요성을 결과 변수로 하였습니다.
3. 268 명이 대상이 되었으며, 내시경적 치료는 120명이 받았으며, 단독약물치료는 148명이 받았습니다.
4. 내시경 치료군의 재출혈 발생률은 5.8%, 약물 치료군은 18.9%였습니다. 내시경 치료군의 재출혈 위험은 약물 치료군에 비해 유의하게 낮았습니다(상대위험도 [RR] = 0.40, 95% 신뢰구간 [CI]: 0.16–0.95).
5. 사망률(RR = 0.90, 95% CI: 0.23–3.59)과 수술 필요성(RR = 0.48, 95% CI: 0.10–2.28)은 두 군 간 차이가 없었습니다.
6. 내시경 치료군의 입원 기간과 수혈 요구량이 약간 줄었으나 통계적으로 유의미하지 않았습니다.
결론적으로, 내시경적 치료는 궤양의 부착 혈전을 동반한 환자에서 재출혈 위험을 효과적으로 감소시킬 수 있는 것으로 확인되었습니다. 사망률이나 수술 필요성에서는 약물 치료와 큰 차이가 없었지만, 재출혈 예방이 중요한 환자군에서 내시경적 접근이 유리하겠습니다. 본 연구에서는 내시경 지혈술 중 아드레날린 주사와 열응고를 병행한 치료가 재출혈 예방에 가장 효과적이었습니다.
따라서, Forrest IIb의 병변이라면, 재출혈 예방이 중요하다면 내시경 지혈술을 선호할 수 있겠으며, 내시경 지혈술 시행이 어려운 상태라면, 약물치료를 하며 조심스럽게 관리할 수 있겠습니다.
논문 바로가기 ▶







